La química es la ciencia que estudia la composición de la materia y los cambios que en ella ocurre.
Durante el siglo V a. C., entre los años 400 al 370 a. C. El filósofo griego Demócrito junto con su maestro Leucipo formularon que la composición de la materia era una partícula indivisible llamada átomo (del griego a = sin y tomos = división).
La escuela de Aristóteles, en cambio planteaba la continuidad de la materia y explicaba al universo considerando 4 elementos (Tierra, Aire, Fuego y Agua) como formadores de la naturaleza.
La Teoría de los cuatro elementos.
Las ideas de Demócrito y Leucipo sólo tuvieron eco cuando en 1808 John Dalton plantea los primeros embozos de lo que sería la Teoría atómica, con gran repercusión en la comunidad científica.
POSTULADOS ATÓMICOS
Según este modelo los átomos eran considerados diminutas esferas rígidas de masa fija.
Según este modelo los átomos eran considerados diminutas esferas rígidas de masa fija. En 1808 publicó un nuevo Sistema de Filosofía Química en la que se discutía la teoría atómica.
De este modo se dio el golpe final a la teoría de la transmutación de los metales en términos alquímicos. Toda la evidencia apuntaba a que cada uno de los diferentes metales estaba formado por tipos diferentes de átomos.
Además los átomos se consideraban indivisibles e invariables y por lo tanto no podría aceptarse que un metal se pudiese transformar en otro.
El modelo de Dalton no habla acerca de cómo están constituidos los átomos, sino de su existencia. Los científicos pasaron siglos prediciendo su existencia mediante observaciones indirectas. Hoy en día no tenemos duda alguna: la naturaleza de la materia es discontinua; existe en forma de pequeñísimas partículas.
La teoría atómica explica también la Ley de las proporciones múltiples. Por ejemplo:6,00 gr de carbono se combinan con 8,00g de oxígeno para formar monóxido de carbono, y con 16,00 g de oxígeno para formar dióxido de carbono. El dióxido de carbono tiene una masa de oxígeno por gramo de carbono (CO2).
El modelo de Dalton no habla acerca de cómo están constituidos los átomos, sino de su existencia. Los científicos pasaron siglos prediciendo su existencia mediante observaciones indirectas. Hoy en día no tenemos duda alguna: la naturaleza de la materia es discontinua; existe en forma de pequeñísimas partículas.
LAS LEYES DE LAS COMBINACIONES QUÍMICAS A LA LUZ DE LA TEORÍA ATÓMICA DE DALTON.
De la teoría de Dalton se deduce con claridad la diferencia entre elemento y compuesto.
Los ELEMENTOS se componen de un solo tipo de átomos.
Los COMPUESTOS están formados por dos o más tipos de átomos combinados químicamente en proporciones definidas.
Para explicar la Ley de proporciones definidas Dalton razonó más o menos así: ¿Por qué tendría 1,0 g de hidrógeno que combinarse siempre con 19 g de flúor?¿Por qué no podría 1,0 g de hidrógeno combinarse con 18 g de flúor?¿O con otra masa cualquiera de flúor?. Si la masa de flúor es 19 veces mayor que la de un átomo de hidrógeno, el compuesto formado por la unión de un átomo de cada elemento tendría que consistir en 1 parte en masa de hidrógeno y 19 partes de masa de flúor. Para que la ley de las proporciones definidas sea válida es preciso que la materia sea de naturaleza atómica.
La siguiente figura muestra una reacción química entre átomos de plomo y azufre interpretada en términos de la teoría de Dalton.
La teoría atómica explica también la Ley de las proporciones múltiples. Por ejemplo:6,00 gr de carbono se combinan con 8,00g de oxígeno para formar monóxido de carbono, y con 16,00 g de oxígeno para formar dióxido de carbono. El dióxido de carbono tiene una masa de oxígeno por gramo de carbono (CO2).
Por último, la teoría atómica explica también la Ley de conservación de la masa. Cuando los átomos de carbono se combinan con átomos de oxígeno para formar dióxido de carbono, lo único que ocurre es que los átomos se reorganizan. N o se pierde ni se gana materia, la masa no cambia.
Hasta entonces se había creído que los átomos eran partículas indivisibles, pero en realidad, pronto surgieron muchas interrogantes que hicieron pensar que la estructura atómica no podía ser tan sencilla como suponía la teoría de Dalton. Entre ellas estaban:
ü Las descargas eléctricas en gases a baja
presión.
presión.
ü El fenómeno de la radiactividad.
ü Los espectros de emisión.
ü La electrólisis.
CUESTIONARIO
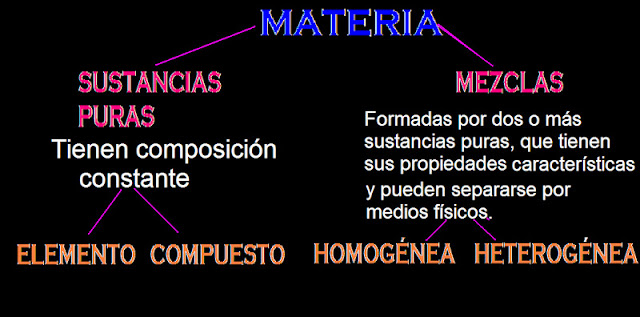
1. ¿Qué relación existe entre elementos, compuestos y mezclas?
Respuesta:
ELEMENTOS: Es un solo tipo de átomo. MOLÉCULAS: Son sustancias que están formadas por átomos iguales.
COMPUESTOS: Son sustancias constituidas por átomos de diferentes elementos.
MEZCLAS: Formadas por dos o más sustancias puras que tienen propiedades características y que puede separarse por métodos físicos (formado por compuestos distinto).
2. Explique la diferencia entre una transformación física y una química.
Ejemplifique.
Ejemplifique.
Respuesta:
ü
CAMBIO FÍSICO: La sustancia sólo varía en su estado o su forma.
CAMBIO FÍSICO: La sustancia sólo varía en su estado o su forma.
ü
Por ejemplo: Los cambios de estado del agua.
Por ejemplo: Los cambios de estado del agua.
ü
CAMBIO QUÍMICO: La sustancia se transforma en otra diferente.
CAMBIO QUÍMICO: La sustancia se transforma en otra diferente.
ü
Por ejemplo: Un papel quemado.
Por ejemplo: Un papel quemado.
3. En qué consiste la Teoría Atómica de Dalton?¿Cómo dicha teoría explica las leyes de la química?
Respuesta:
La teoría de Dalton deduce con claridad la diferencia entre elemento y compuesto.
ELEMENTOS: Es un solo tipo de átomo. MOLÉCULAS: Son sustancias que están formadas por átomos iguales.
COMPUESTOS: Son sustancias constituidas por átomos de diferentes elementos combinados químicamente en proporciones definidas.
La Teoría explica las siguientes leyes de la química:
1. Ley de proporciones definidas
2. Ley de las proporciones múltiples.
3. Ley de conservación de la masa
4.- Definición de átomo (Daltón)
Respuesta:










No hay comentarios:
Publicar un comentario